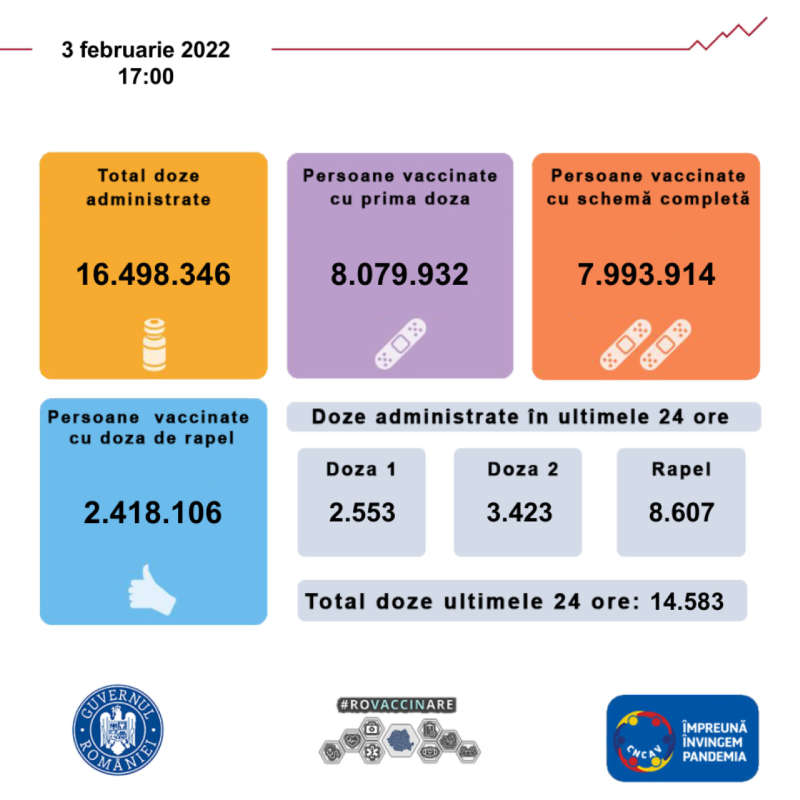
Medicamentul Lartruvo (olaratumab, produs de Eli Lilly & Company) în asociere cu doxorubicină nu prelungește viața pacienților cu cancer

Agenția Europeană a Medicamentului (EMA) a finalizat evaluarea rezultatelor obținute în studiul clinic de fază 3 ANNOUNCE și a ajuns la concluzia că m de țesuturi moi mai mult decât doxorubicina singură. EMA recomandă astfel revocarea autorizației de punere pe piață a medicamentului respectiv.
Lartruvo a fost autorizat în Uniunea Europeană în noiembrie 2016 prin procedură accelerată (a fost declarat medicament orfan în 2015), dar cu condiția ca firma producătoare (Eli Lilly & Company) să furnizeze date suplimentare, prin studiul ANNOUNCE, care să confirme eficacitatea și siguranța medicamentului.
Lartruvo este un medicament oncologic autorizat pentru tratamentul sarcoamelor avansate de țesut moale. Autorizarea inițială, acordată condiționat, era pentru tratamentul combinat de olaratumab și doxorubicină la pacienții care nu pot urma tratamentul chirurgical sau prin radioterapie și care nu au primit anterior doxorubicină.
În ianuarie 2019, compania Lilly a dat publicității rezultatele preliminare ale studiului ANNOUNCE. Acestea nu au confirmat eficacitatea medicamentului, astfel că, imediat, EMA a emis recomandarea ca niciun pacient nou să nu mai primească Lartruvo (olaratumab).
Anunțul făcut zilele acestea vine după ce Agenția Europeană a Medicamentului a evaluat în întregime datele din studiul clinic și a ajuns la concluzia că beneficiul terapeutic al combinației de olaratumab și doxorubicină nu se confirmă. Datele nu au indicat probleme suplimentare legate de siguranța tratamentului.
Acesta este primul caz al unui medicament autorizat condiționat în care EMA recomandă retragerea autorizației. Decizia de retragere a autorizației de punere pe piață va fi luată de autoritatea emitentă, adică de Comisia Europeană, și va fi obligatorie pentru toate statele Uniunii Europene și din Spațiul Economic European.