EMA evaluează eficacitatea rapelului cu vaccinul Johnson&Johnson
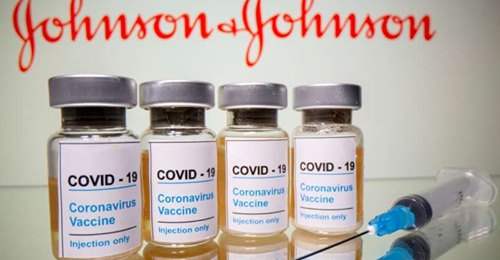
Agenţia Europeană pentru Medicamente (EMA) a anunţat luni că a început să evalueze o cerere depusă de compania americană Johnson&Johnson în vederea administrării unei doze de rapel cu vaccinul său anti-COVID-19 pentru persoanele cu vârste de peste 18 ani din Uniunea Europeană, informează AFP.
Dacă EMA va emite un aviz pozitiv, serul Johnson&Johnson va deveni cel de-al treilea vaccin anti-COVID-19 – după cele dezvoltate de Pfizer-BioNTech şi Moderna – care va putea fi utilizat în UE pentru administrarea unui rapel la adulţi. Doza de rapel va putea fi administrată la cel puţin două luni după prima inoculare cu acest vaccin monodoză.
„Comitetul pentru medicamente de uz uman (CHMP) din cadrul EMA va realiza o evaluare accelerată a datelor trimise de compania care comercializează acest vaccin”, au anunţat reprezentanţii EMA, adăugând că un rezultat al analizei este „aşteptat în săptămânile următoare”.
Datele analizate de EMA, al cărei sediu se află la Amsterdam, conţin rezultate medicale obţinute de la peste 14.000 de adulţi care au primit a doua injecţie cu serul Johnson&Johnson sau un placebo, a precizat agenţia europeană.
În total, EMA a autorizat utilizarea a patru vaccinuri dezvoltate împotriva COVID-19: cele create de Pfizer şi Moderna, care se bazează pe tehnologia ARN mesager, şi cele produse de AstraZeneca şi Johnson&Johnson, care au la bază tehnologia vectorului viral. AGERPRES